Introduction
Les lésions du Ligament croisé antérieur (LCA) sont une des lésions ligamentaires les plus couramment retrouvées chez les jeunes sportifs, avec une incidence annuelle en Allemagne de 46/100000 (1), de 85/100000 aux Etats-Unis avec plus de 200000 nouvelles lésions par an (2,3). Ces lésions sont rencontrées dans la population générale, mais surtout chez les jeunes sportifs de haut niveau, notamment, les joueurs de football, skieurs et gymnastes (4).
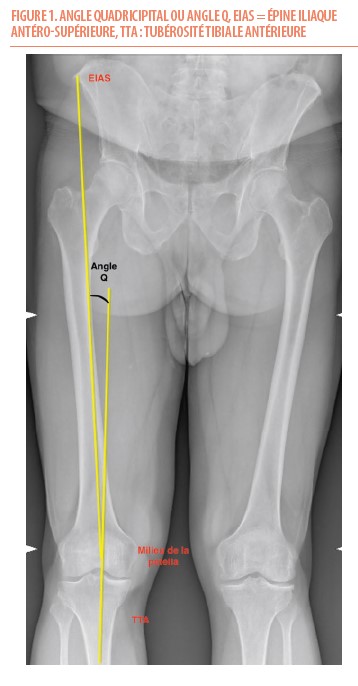
Les lésions du LCA sont plus couramment observées chez les femmes que chez les hommes ; en effet, le sexe féminin est un « facteur de risque » pour ces lésions. Ce risque est en réalité plus lié à des facteurs anatomiques (volume quadricipital moindre, angle quadricipital majoré (Figure 1), échancrure intercondylienne plus étroite et augmentation de la pente tibiale postérieure) propre au sexe (5). D’autres facteurs tels que le jeune âge, la participation à des activités sportives intenses et fréquentes, surtout à un âge plus jeune, sont également des facteurs de risque de lésion du LCA (6).
Anatomie
Le LCA empêche la translation antérieure du tibia par rapport au fémur. Il inhibe également, mais à moindre mesure, la rotation interne du tibia par rapport au fémur.
La présence de nombreuses terminaisons nerveuses implique que le LCA ait également une fonction proprioceptive au niveau du genou.
L’anatomie du LCA est très importante surtout si une reconstruction est envisagée. Des repères anatomiques fiables au tibia et au fémur devront être identifiées pour la position des différents tunnels.
Le LCA est attaché sur le tibia antéro-latéralement par rapport au tubercule tibial médial, dans la fosse inter-condylienne, médialement par rapport à la corne antérieure du ménisque latérale. Cette insertion prend la forme d’un « C ». Le ligament se dirige postéro-latéralement en pivotant sur lui-même pour s’insérer à la face postéro-médiale du condyle fémoral latéral, en forme de « croissant », ou d’une « virgule » (7).
Le LCA est une structure ligamentaire composé de tissus conjonctifs, à leur tour formés par des réseaux parallèles de fibroblastes de collagène de type 1. Il ne fonctionne pas comme un simple élastique soumis à une tension constante, mais plutôt comme plusieurs groupes de fibres soumis à un étirement et à une déformation lors de la flexion-extension.
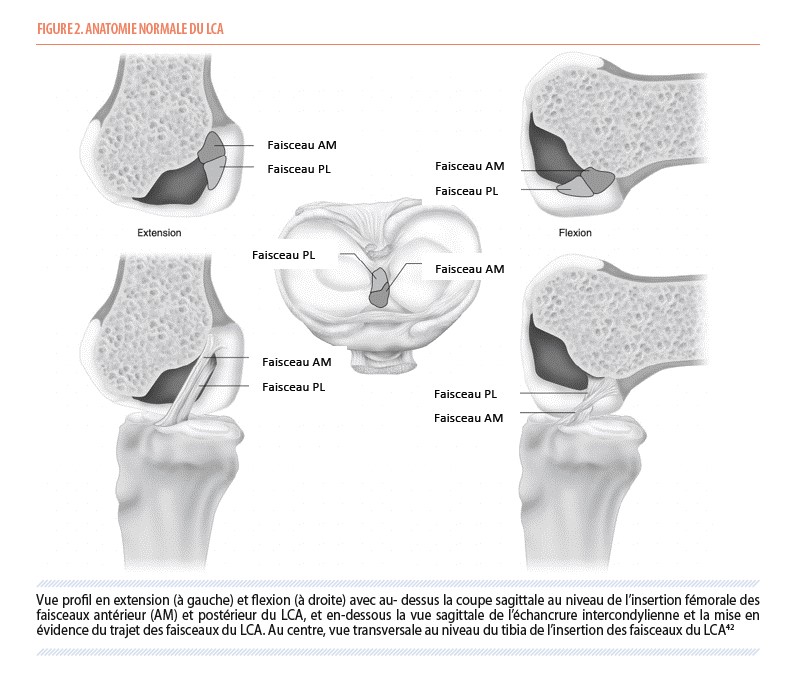
Il fut donc historiquement décrit comme composé de deux faisceaux majeurs ; un antéro-médial (AM) et un postéro-latéral (PL), nommés ainsi en fonction de leur insertion tibiale et fémorale (8,9). Actuellement, des études histologiques ont démontrés qu’il a plutôt une forme de « ruban » torsadé, se déformant en flexion. Les fibres du LCA imprimeraient une torsion sur eux-mêmes, en fonction de la position relative des insertions osseuses, ce qui lui confèrerait une apparence de « double faisceaux » (Figure 2) (10,11).
Bien que ce ligament soit intra-articulaire, il est couvert d’une membrane synoviale, ce qui implique que cette structure est considérée comme extra-synoviale (1). La vascularisation est assurée par l’artère géniculée moyenne et les artères géniculées inférieures (7).
Pathologie
Les mécanismes de lésions les plus couramment rencontrés sont les traumatismes sans contact (saut, décélération, changement de direction brutal) en pivot, impliquant des manœuvres de rotations du tibia et/ou de valgus du genou en extension ou légère flexion.
D’autres lésions résultent de contact direct avec un genou en hyperextension ou en valgus.
Clinique
L’examen clinique du genou permet en général le diagnostic de rupture de LCA, surtout si celui-ci est effectué peu de temps après la lésion, avant l’installation de la douleur, du gonflement ou des spasmes musculaires.
En général, les patients se présentent plus tardivement, avec un genou gonflé et douloureux, un épanchement articulaire et des amplitudes articulaires diminuées. Une histoire de traumatisme avec ou sans contact est souvent décrite, parfois accompagné d’un « claquement » audible par le patient et d’une sensation de déchirure.
L’examen clinique comprendra les tests suivants:
- Signe du levier ou test de Lelli: ce test peut être réalisé en aigu sans induire une douleur significative. Patient allongé sur le dos, jambe en extension, un poing du praticien est placée sous le tiers proximal du mollet, avec l’autre main, le praticien applique une force descendante sur le tiers distal du quadriceps. Le test est négatif si le talon se lève de la table et est positif (rupture de LCA), si le talon ne se lève pas de la table (translation antérieur du tibia par rapport au fémur). Ce test offre une sensibilité de plus de 92% pour les lésions aigues (12,13).
- Test de Lachman : à ٢٠-30° de flexion, fémur stabilisé par une main, on imprime une translation antérieure du tibia avec l’autre main. Ce test est positif si cette translation est supérieure d’au moins trois millimètres par rapport au côté controlatéral ou si on ressent un arrêt mou ou différé. Ce test offre une sensibilité de 85-87% et une spécificité de 94%.
- Test du tiroir antérieur : à 90° de flexion, on imprime une translation antérieur brusque du tibia. Ce test est également positif si cette translation est supérieure d’au moins six millimètres par rapport au côté controlatéral ou si on ressent un arrêt mou ou différé. Ce test offre une sensibilité de 92% et une spécificité de 91% pour les lésions chroniques, ce test est moins performant sur des lésions aigues (14,15).
- Pivot shift test : ce test repose sur la subluxation dynamique se produisant lors des 20 à 40 premiers degrés de flexion du genou lorsque celui-ci présente une lésion du LCA. Départ genou en extension complète avec une charge axiale, rotation interne et valgus, il existe une subluxation antérieure du tibia se réduisant vers 30° de flexion. On le classe selon la classification de Jakob (grade 1 : glissade, grade ٢ : clunk, grade 3 : blocage). Ce test présente une sensibilité de seulement 24% et une spécificité de 98%, autant dans les situations aigues que chroniques (14,15).
Avant de tester le ligament croisé antérieur, il est conseillé de tester le ligament croisé postérieur (LCP) afin d’éviter les faux positifs (tiroir postérieur, effacement de la tubérosité tibiale postérieure, test d’activation quadricipital, test de rotation externe et recurvatum ainsi que le pivot shift test postérieur).
Diagnostic
Des radiographies simples (incidences de face, profil, trois-quarts et fémoro-patellaire en position. couchée) seront toujours demandées afin d’exclure des lésions osseuses post traumatiques, des corps libres, une maladie dégénérative (ex : arthrose déjà avancée avec formation ostéophytique), …
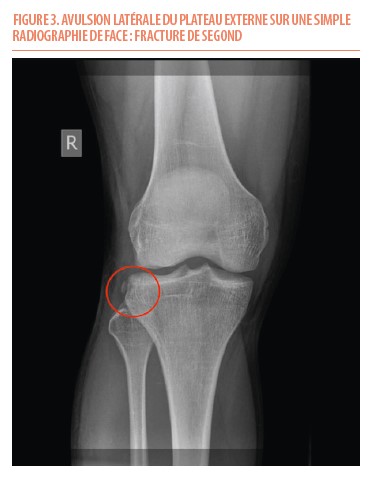
La radiographie peut parfois permettre le diagnostic de rupture de LCA. La fracture de Segond (Figure 3), lésion osseuse pathognomique de la rupture du LCA, correspondant à une avulsion de la partie antéro-latérale du tibia, est visualisée sur de simples radiographies. Cette avulsion est considérée comme une avulsion ligamentaire puisqu’elle correspond à la zone d’insertion du ligament antéro-latérale (ALL) (16–18).
Dans la majorité des cas, les radiographies sont normales en dehors d’un épanchement articulaire.
L’imagerie par résonance magnétique (IRM) reste l’examen de choix, mais ne dispense pas de la réalisation de radiographies simples. L’IRM permet non seulement d’objectiver et de caractériser la rupture du LCA, mais également d’exclure toutes autres lésions associées (lésion du LCP, méniscale, cartilagineuse, ligaments collatéraux,…). Une rupture de LCA et des lésions concomitantes du ligament collatéral médial (LCM) et des lésions méniscales sont fréquentes (prévalence respective de 30% et 42%) (19).
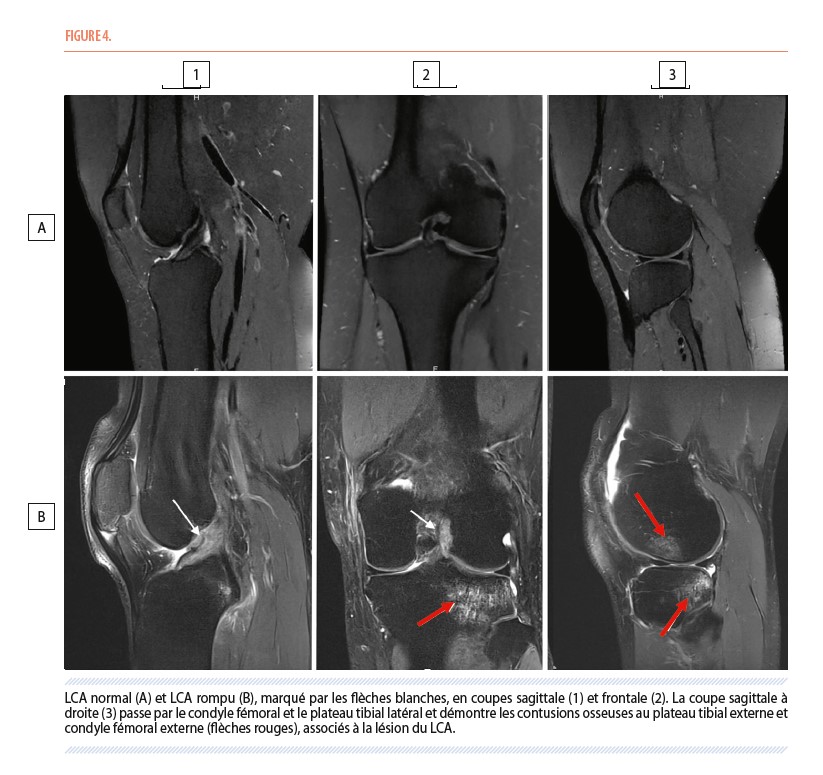
Les caractéristiques directes d’une rupture de LCA sont l’interruption de continuité de celui-ci, absence de celui-ci en position anatomique, des contours ondulés du LCA, voir une perturbation diffuse du signal de celui-ci. Outre ces signes directs, il peut y avoir des signes indirects de rupture, tels que, des contusions osseuses du plateau tibial postéro-latérale et la partie antérieure du condyle fémoral latéral (Figure 4).
L’arthro-scanner peut s’avérer utile lorsque l’IRM est contre indiquée pour des raisons médicales.
L’imagerie par tomodensitométrie (CT scanner) sera utile en cas de fracture associée ou pour les re-rupture (évaluation des tunnels osseux). Ces différents cas ne seront pas abordés dans cet article.
Traitement
Il convient de réaliser les radiographies le jour du traumatisme afin d’exclure toute fracture associée.
Si une fracture est objectivée, le traitement dépendra de cette fracture (nous n’aborderons pas ce sujet dans cette article).
S’il n’y a pas de fracture et qu’un doute subsiste sur l’état ligamentaire, il est nécessaire d’immobiliser le membre avec une attelle cruro-malléollaire, prescrire une IRM et renvoyer le patient vers un service d’orthopédie.
Les objectifs de la prise en charge d’une lésion de LCA sont de restaurer la fonction du genou, la reprise des activités sportives, la prévention des lésions secondaires (lésions chondrales et méniscales secondaire à l’instabilité post lésionnelle) et la récupération d’une qualité de vie à terme (20).
Traitement non chirurgical
Tous les patients présentant des lésions du LCA ne sont pas nécessairement candidats à une intervention chirurgicale. De nombreuses comorbidités, une activité physique réduite et/ou dans un plan (ex : cyclisme, natation, fitness,…), un pauvre état articulaire (ex : gonarthrose avancée, maladie rhumatismale inflammatoire,…), une faible instabilité post traumatique sont des critères à prendre en compte et pouvant exclure la prise en charge chirurgicale.
Le traitement consiste en un traitement par kinésithérapie durant un minimum de 6 à 12 semaines. Il vise à récupérer de bonnes amplitudes articulaires, en un travail de renforcement musculaire progressif du quadriceps, des ischio-jambiers et des adducteurs de la hanche ainsi qu’à un retour progressif aux activités. Une réévaluation est recommandée à 3 mois du traumatisme afin d’évaluer l’efficacité de la rééducation et l’instabilité résiduelle. Si elle reste importante, le patient pourrait se voir proposer une reconstruction du LCA (21,22).
Traitement chirurgical
Chez les patients jeunes, en bonne santé, les patients avec une demande fonctionnelle importante, pratiquant notamment des sports en pivot et/ou de contact, présentant une instabilité importante, dont le traitement conservateur a échoué ou des lésions associées ont été mises en évidence, le traitement chirurgical sera préféré.
L’âge n’est pas un critère d’exclusion strict au traitement chirurgical. Au-delà de 40 ans, la sélection des patients sera plus rigoureuse, et une haute exigence fonctionnelle, sportive ainsi qu’une absence de signes radiologiques d’arthrose seront des critères essentiels dans cette catégorie de patients. Des résultats comparables seront attendues chez ces patients si une bonne sélection est entreprise (23,24).
De nombreux scores fonctionnels subjectifs (IKDC, KOOS, Tegner-Lysholm) permettent de mesurer l’instabilité subjective. Ces scores reposent en général sur des questionnaires que le patient doit remplir avec le praticien. Le score le plus utilisé dans le cadre d’une instabilité post lésionnelle du LCA est celui de Tegner-Lysholm (25). L’instabilité objective sera évaluée grâce aux tests cliniques précédemment décrits.
La reconstruction du LCA est recommandée afin d’éviter une majoration de la laxité antéro-postérieure et rotatoire, source de complications ultérieures (lésions chondrales et méniscales secondaire à l’instabilité) au niveau du genou.
Le timing opératoire ne semble pas influer sur les résultats post-opératoires des ligamentoplasties (26)
Cependant, le moment de la chirurgie peut affecter la survenue et le développement de lésions secondaires associées.
L’American Academy of Orthopaedic Surgeons (AAOS) recommande 12 semaines de traitement conservateur en cas de déchirure isolée du LCA, suivies d’une réévaluation sur la nécessité d’une intervention chirurgicale. Cette stratégie semble être la plus appropriée pour une population standard, de patients d’âge moyen avec des activités modérées. Cependant, il convient de prendre en compte la situation personnelle et professionnelle du patient. Pour des raisons économiques, les athlètes ou jeunes patients avec une forte demande sportive bénéficieront d’une prise en charge chirurgicale plus rapide (27, 28).
Si une reconstruction est indiquée, elle est recommandée dans les 3 à 5 mois suivant la déchirure (22). Au-delà de ce délai, une reconstruction est toujours possible ; cependant, il existe un risque accru de lésions chondrales et méniscales secondaires en raison de l’instabilité, elle-même causée par la lésion primaire du LCA (29-31).
Les facteurs influençant la réussite de la reconstruction sont : la sélection du greffon, l’emplacement des tunnels osseux, la tension exercée au niveau du greffon, les fixations utilisées et l’incorporation des greffons.
Il existe une variété d’options de greffons, de dispositifs de fixations et de techniques chirurgicales dans la chirurgie de reconstruction de LCA. À ce jour, il n’existe pas de « gold standard » quant à la méthode chirurgicale optimale de reconstruction de LCA. Les chirurgiens planifient leur chirurgie en fonction de leur formation, de leur préférence, des évidences issues des données scientifiques et des tendances locales s’appuyant sur différents consensus (32).
Les différentes choix possible pour les greffons se font parmi les allogreffes, les autogreffes des ischio-jambiers (tendons du gracile et semi-tendineux (IJ), du tendon rotulien/bone to bone (BTB) et du tendon quadricipital (QT). Les autogreffes semblent être une meilleure option, avec des taux de re-rupture inférieurs à ceux des allogreffes (Tableau 1) (33-35). La tendance actuelle est en faveur des greffons des ischio-jambiers dans le monde entier, à l’exception de l’Amérique du Nord, où le tendon rotulien est encore prédominant (32). En Europe, l’utilisation des IJ chez les patients avec peu de demande fonctionnelle alors que le QT chez les patients pratiquant un sport de contact semble être la règle.
Les procédures extra-articulaires par reconstruction de l’ALL ou les ténodèses latérales sont également en plein essor en Europe, lorsqu’une importante laxité rotatoire est présente et sont souvent associés aux autogreffes des IJ (32,36).
Avant toute procédure chirurgicale, le genou ne devra plus être inflammatoire, gonflé, et douloureux. Une extension complète et une flexion de plus de 90° devront avoir été obtenues.
Suivi post-opératoire
Rééducation
Les objectifs de la rééducation sont de restaurer des mouvements articulaires normaux, d’obtenir une force normale, tout en protégeant le greffon. Lors de la reconstruction du LCA isolée, sans geste associée, la mise en charge est immédiate, protégée ou non par une attelle articulée quelques jours. L’utilisation à long terme de l’attelle n’est plus recommandée car aucun bénéfice à long terme n’a été démontrée (22,37,38).
Le retour à l’activité sportive fait partie intégrante du processus de rééducation. Différents impératifs devront être remplis avant la reprise des activités sportives. La reprise sportive sera possible si le patient est prêt physiquement, mentalement et si une guérison biologique est obtenue. Différents tests évalueront les capacités physiques du patient (test isocinétique, test de résistance, test de saut et test d’agilité).
Il est recommandé de retarder le retour au sports pivot au-delà de 9 mois après une chirurgie de reconstruction du LCA (39–41).
Complications
En plus des complications chirurgicales classiques, les complications suivantes ont été recensées lors de chirurgie de reconstruction de LCA. La complication la plus courante est l’infection superficielle de la plaie, qui représente moins de 1% des cas opératoires (2).
D’autres complications, plus rares, ont été rapportées ; infection articulaire profonde, hémarthrose post-opératoire, inhibition transitoire du quadriceps, mauvais positionnement de la greffe avec perte d’amplitude articulaire, arthrofibrose (par augmentation chronique des tissus inflammatoires avec surproduction de tissus cicatriciels), relâchement secondaire de la plastie avec instabilité résiduelle (42,43).
Un placement imprécis des tunnels peut être une source d’échecs de la plastie de LCA ; un tunnel fémoral trop antérieur ne permet pas de reproduire l’orientation oblique du LCA primaire, et restaure donc de manière limitée la stabilité du genou. Un tunnel tibial trop antérieur, peut quant à lui entrainer un conflit de la plastie avec l’échancrure intercondylienne.
Recommandations pratiques
L’objectif de la prise en charge des ruptures de LCA est de restaurer la fonction du genou, de prévenir les lésions secondaires ainsi que la gonarthrose et d’optimiser une qualité de vie à terme. La rééducation doit commencer le plus tôt possible après la blessure et doit se faire par étapes fonctionnelles spécifiques. Après une examen clinique méticuleux et approfondit, l’IRM est indiquée pour confirmer le diagnostic de rupture du LCA et des lésions concomitantes.
Le jeune âge du patient, des activités sportives professionnelles ou importantes notamment en pivot-contact, une laxité résiduelle malgré un traitement conservateur bien conduit (supérieur grade 2) et des lésions intra-articulaires associées sont des arguments en faveur d’une prise en charge chirurgicale. Une discussion avec le patient est nécessaire afin d’élaborer le meilleur plan thérapeutique en fonction des attentes de celui-ci.
Références
- Kohn L, Rembeck E & Rauch A Anterior cruciate ligament injury in adults : Diagnostics and treatment. Orthopade. 2020; 49: 1013–1028.
- Musahl V & Karlsson J. Anterior Cruciate Ligament Tear. N Engl J Med. 2019; 380: 2341–2348.
- Diermeier T. et al. Treatment after anterior cruciate ligament injury: Panther Symposium ACL Treatment Consensus Group. J ISAKOS. 2021; 6: 129–137.
- Siegel L, Vandenakker-Albanese C & Siegel D. Anterior cruciate ligament injuries: anatomy, physiology, biomechanics, and management. Clin J Sport Med. 2012; 22: 349–355.
- Sutton KM & Bullock JM. Anterior cruciate ligament rupture: differences between males and females. J Am Acad Orthop Surg. 2013; 21: 41–50.
- Ladenhauf HN, Graziano J & Marx RG. Anterior cruciate ligament prevention strategies: are they effective in young athletes - current concepts and review of literature. Curr Opin Pediatr. 2013; 25: 64–71.
- Markatos K, Kaset, MK, Lallos SN, Korres DS. & Efstathopoulos N. The anatomy of the ACL and its importance in ACL reconstruction. Eur J Orthop Surg Traumatol. 2013; 23: 747–752.
- Giuliani JR, Kilcoyne KG, Rue JP. Anterior cruciate ligament anatomy: a review of the anteromedial and posterolateral bundles. J Knee Surg. 2009 Apr;22(2).
- Buoncristiani AM, Tjoumakaris FP, Starman JS, Ferretti M, Fu FH. Anatomic double-bundle anterior cruciate ligament reconstruction. Arthroscopy. 2006 Sep;22(9):1000-6. doi: 10.1016/j.arthro.2006.06.005. PMID: 16952731.
- Śmigielski R, Zdanowicz U, Drwięga M, Ciszek B & Williams, A. The anatomy of the anterior cruciate ligament and its relevance to the technique of reconstruction. Bone Joint J. 2016; 98-B: 1020–1026.
- Noailles T, Boisrenoult P, Sanchez M, Beaufils P & Pujol N. Torsional Appearance of the Anterior Cruciate Ligament Explaining ‘Ribbon’ and Double-Bundle Concepts: A Cadaver-based Study. Arthroscopy. 2017; 33: 1703–1709.
- Lelli A, Di Turi RP, Spenciner DB & Dòmini M. The ‘Lever Sign’: a new clinical test for the diagnosis of anterior cruciate ligament rupture. Knee Surg Sports Traumatol Arthrosc. 2016; 24, 2794–2797.
- Guiraud K. et al. Higher sensitivity with the lever sign test for diagnosis of anterior cruciate ligament rupture in the emergency department. Arch Orthop Trauma Surg. 2022; 142: 1979–1983.
- Benjaminse A, Gokeler A & van der Schans CP. Clinical diagnosis of an anterior cruciate ligament rupture: a meta-analysis. J Orthop Sports Phys Ther. 2006; 36: 267–288.
- Huang W, Zhang Y, Yao Z & Ma L. Clinical examination of anterior cruciate ligament rupture: a systematic review and meta-analysis. Acta Orthop Traumatol Turc. 2016; 50: 22–31.
- Claes S, Luyckx T, Vereecke E & Bellemans J. The Segond fracture: a bony injury of the anterolateral ligament of the knee. Arthroscopy. 2014; 30: 1475–1482.
- Shaikh H et al. The Segond Fracture Is an Avulsion of the Anterolateral Complex. Am J Sports Med. 2017; 45: 2247–2252.
- Helito PV P, Bartholomeeusen S, Claes S, Rodrigues MB & Helito CP. Magnetic Resonance Imaging Evaluation of the Anterolateral Ligament and the Iliotibial Band in Acute Anterior Cruciate Ligament Injuries Associated With Segond Fractures. Arthroscopy. 2020; 36: 1679–1686.
- Frobell RB, Lohmander LS & Roos HP. Acute rotational trauma to the knee: poor agreement between clinical assessment and magnetic resonance imaging findings. Scandinavian J Med & Sci Sports. 2007; 17: 109–114.
- Filbay S R & Grindem H. Evidence-based recommendations for the management of anterior cruciate ligament (ACL) rupture. Best Pract Res Clin Rheumatol. 2019; 33: 33–47.
- Hetsroni I et al. Nonoperative treatment for anterior cruciate ligament injury in recreational alpine skiers. Knee Surg Sports Traumatol Arthrosc. 2013; 21:1910–1914.
- Brophy RH & Lowry KJ. American Academy of Orthopaedic Surgeons Clinical Practice Guideline Summary: Management of Anterior Cruciate Ligament Injuries. J Am Acad Orthop Surg. 2023; 31: 531–537.
- Fayard JM et al. Factors affecting outcome of ACL reconstruction in over-50-year-olds. Orthop Traumatol Surg Res. 2019; 105: S247–S251.
- Panisset JC et al. ACL reconstruction in over-50 year-olds: Comparative study between prospective series of over-50 year-old and under-40 year-old patients. Orthop Traumatol Surg Res. 2019; 105: S259–S265.
- Briggs KK et al. The reliability, validity, and responsiveness of the Lysholm score and Tegner activity scale for anterior cruciate ligament injuries of the knee: 25 years later. Am J Sports Med. 2009; 37: 890–897.
- Andernord D. et al. Timing of surgery of the anterior cruciate ligament. Arthroscopy. 2013; 29: 1863–1871.
- Eggerding V et al. ACL reconstruction for all is not cost-effective after acute ACL rupture. Br J Sports Med. 2022; 56: 24–28.
- Deviandri R, van der Veen HC, Lubis AMT, van den Akker-Scheek I & Postma MJ. Cost-effectiveness of ACL treatment is dependent on age and activity level: a systematic review. Knee Surg Sports Traumatol Arthrosc. 2023; 31: 530–541.
- Anderson AF & Anderson CN. Correlation of meniscal and articular cartilage injuries in children and adolescents with timing of anterior cruciate ligament reconstruction. Am J Sports Med. 2015; 43: 275–281.
- Newman JT et al. Factors predictive of concomitant injuries among children and adolescents undergoing anterior cruciate ligament surgery. Am J Sports Med. 2015; 43: 282–288.
- Petersen W et al. Management after acute rupture of the anterior cruciate ligament (ACL). Part 1: ACL reconstruction has a protective effect on secondary meniscus and cartilage lesions. Knee Surg Sports Traumatol Arthrosc. 2023; 31: 1665–1674.
- Tuca M, Valderrama I, Eriksson K & Tapasvi S. Current trends in anterior cruciate ligament surgery. A worldwide benchmark study. J ISAKOS. 2023; 8: 2–10.
- Li J et al. A Prospective Randomized Study of Anterior Cruciate Ligament Reconstruction With Autograft, γ-Irradiated Allograft, and Hybrid Graft. Arthroscopy. 2015;31: 1296–1302.
- Mouarbes D et al. Anterior Cruciate Ligament Reconstruction: A Systematic Review and Meta-analysis of Outcomes for Quadriceps Tendon Autograft Versus Bone-Patellar Tendon-Bone and Hamstring-Tendon Autografts. Am J Sports Med. 2019; 47: 3531–3540.
- Björnsson H et al. A Randomized Controlled Trial With Mean 16-Year Follow-up Comparing Hamstring and Patellar Tendon Autografts in Anterior Cruciate Ligament Reconstruction. Am J Sports Med. 2016; 44: 2304–2313.
- Cerciello S et al. ACL surgical trends evolve in the last five years for young European surgeons: results of the survey among the U45 ESSKA members. Knee Surg Sports Traumatol Arthrosc. 2023;31: 619–625.
- Smith SD, Laprade RF, Jansson KS, Arøen A. & Wijdicks CA. Functional bracing of ACL injuries: current state and future directions. Knee Surg Sports Traumatol Arthrosc. 2014; 22, 1131–1141.
- Ma R, Sheth C, Fenkel, B & Buyuk AF. The Role of Bracing in ACL Injuries: The Current Evidentiary State of Play. J Knee Surg. 2022; 35: 255–265.
- Kaplan, Y. & Witvrouw, E. When Is It Safe to Return to Sport After ACL Reconstruction? Reviewing the Criteria. Sports Health 11, 301–305 (2019).
- Figueroa D et al. Return to sport soccer after anterior cruciate ligament reconstruction: ISAKOS consensus. J ISAKOS. 2022; 7: 150–161.
- Meredith SJ et al. Return to sport after anterior cruciate ligament injury: Panther Symposium ACL Injury Return to Sport Consensus Group. J ISAKOS. 2021; 6: 138–146.
- Bohu Y. et al. Professional Athletes Are Not at a Higher Risk of Infections After Anterior Cruciate Ligament Reconstruction: Incidence of Septic Arthritis, Additional Costs, and Clinical Outcomes From the French Prospective Anterior Cruciate Ligament Study (FAST) Cohort. Am J Sports Med. 2019; 47: 104-111.
- Hettrich CM, Dunn WR, Reinke EK, MOON Group & Spindler KP. The rate of subsequent surgery and predictors after anterior cruciate ligament reconstruction: two- and 6-year follow-up results from a multicenter cohort. Am J Sports Med. 2013; 41: 1534-1540.
Conflit d’intérêt
Les auteurs attestent n’avoir aucun conflit d’intérêt dans cet article.
Affiliations
Service de Chirurgie Orthopédique et Traumatologie, Cliniques universitaires Saint-Luc, UCLouvain, B-1200 Bruxelles
*contributeurs équivalents
Correspondance
Pr Olivier Cornu
Cliniques universitaires Saint-Luc
Service de Chirurgie Orthopédique et Traumatologie
UCLouvain
Avenue Hippocrate 10
B-1200 Bruxelles