Introduction
Le Monkeypox virus est un virus à ADN double brin et fait partie de la famille des Orthopoxvirus comme le Smallpox virus (la variole) et le Cowpox virus (vaccinia virus) [Figure 1]. Pour rappel, la variole était une maladie virale très contagieuse responsable d’une éruption pustuleuse et la cause de dizaines de milliers de morts par an en Europe jusqu'au 18ème siècle. La variole a été déclarée éradiquée en 1981, grâce à une campagne de vaccination médiée par l'Organisation Mondiale de la Santé (OMS) (1). Le Monkeypox virus a, quant à lui, été isolé pour la première fois en 1958 chez des singes au Statens Serum Institut à Copenhague, bien que les rongeurs constituent probablement le réservoir principal du virus (écureuil, rat, loir) (2). Il existe deux variants du Monkeypox virus. Le premier est endémique en Afrique de l'Ouest et l’autre prédomine dans le bassin du Congo (3). Cette dernière souche est la plus virulente et sévère. L’épidémie actuelle est due au variant de l’Afrique de l’Ouest (3).
Epidémiologie
La première infection à Monkeypox virus chez l’homme date de 1970 en République Démocratique du Congo. Depuis lors, en Afrique de l’Ouest et en Afrique Centrale, cette infection est endémique avec des milliers de cas rapportés chaque année. En 2003, des rongeurs infectés ont été exportés aux Etats Unis depuis le Ghana, résultant en plus de 70 contaminations parmi des êtres humains (4). En 2018, 2 personnes venant du Nigeria ont rapatrié le virus en Angleterre, résultant également en une infection secondaire parmi un membre du personnel de santé (1). En 2021, une famille venant du Nigeria a également été diagnostiquée aux Etats Unis (3). Dans la littérature on peut retrouver d’autres contaminations, en Israël et à Singapour, précédant l’année 2022 (3,4).
Contrairement à ces cas sporadiques rapportés dans le passé, l’épidémie actuelle repose surtout sur la transmission interhumaine. En effet, pour la majorité des contaminations, il n’y a pas d’historique de voyage récent en zone endémique. Cette épidémie a commencé début mai 2022 lorsqu’un cas a été rapporté en Angleterre chez un patient venant du Nigeria. Il n’est pas certain qu’il s’agisse du cas index. Par la suite, 6 cas supplémentaires ont été confirmés une semaine plus tard (1). Depuis lors, en date de 28 juin, 4852 contaminations ont été objectivées dans 49 pays dont 3105 en Europe (les trois pays principaux : Allemagne, Espagne, et Portugal) (3,5). À cette date, on dénombre 117 cas confirmés en Belgique. En Europe, la grande majorité des cas sont décrits chez des hommes ayant des rapports sexuels avec des hommes (HSH) (3).
Des mises à jour régulières sur la situation épidémiologique sont disponibles via Sciensano (Belgique), l’ECDC (Europe) et l’OMS (monde). Le site Our World in Data offre également un aperçu plus interactif et personnalisable par graphique, carte, ou autre (6).
Transmission
Quand l’homme entre en contact avec un animal infecté, il peut accidentellement être contaminé (transmission zoonotique) et transmettre le virus à ses proches (transmission interhumaine) avec un taux d’attaque secondaire aux alentours de 10% (4).
La transmission zoonotique peut résulter d’un contact direct avec du sang, des liquides biologiques ou des lésions cutanées ou muqueuses d’animaux infectés. La consommation de viande insuffisamment cuite peut constituer un facteur de risque. La transmission interhumaine se fait par contact direct (contact intime avec les lésions cutanées) ou via gouttelettes dans une moindre mesure et nécessite en général un contact face à face prolongé. La transmission peut également se faire de la mère à l’enfant via la voie transplacentaire ou lors de l’accouchement. La transmission sexuelle via liquides biologiques n’a pas encore été formellement prouvée bien qu’on puisse retrouver le virus dans les sécrétions génitales (3). Le temps d’incubation dure habituellement 6 à13 jours mais peut varier entre 5 et 21 jours (3).
Symptomatologie
Le patient peut d’abord présenter des symptômes généraux avant-coureurs correspondant à la phase invasive/prodromique comme de la fièvre, des céphalées, des douleurs musculaires, de la fatigue et des douleurs pharyngées (syndrome grippal). Le patient développe alors un rash dans les jours qui suivent (1 à 4 jours après la phase prodromique). Ce rash évolue dans la plupart des cas vers une éruption maculeuse, progressant in fine vers des papules puis des vésicules/pustules. Ces vésicules peuvent s’ulcérer et/ou s’abcéder par la suite [figures 2 et 3] (1,3).
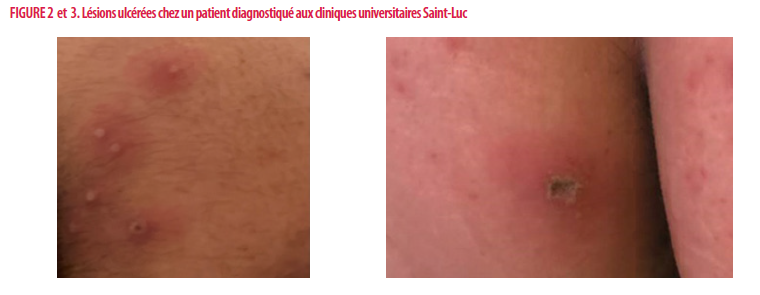
Il y a souvent plusieurs lésions qui se manifestent en bouquet associées à une adénopathie au niveau du territoire de drainage. Ces lésions se développent typiquement au niveau du visage et des extrémités mais peuvent également survenir sur toute autre partie du corps. À noter que durant cette épidémie de 2022, la plupart des lésions se trouvent au niveau de la région génitale et anale. Des cas de proctite ont également été rapportés (7).
Chez la plupart des personnes, l’éruption se résout en 2 à 4 semaines sans complication et le patient n’est plus contagieux à la nouvelle épithélialisation de la peau (1). Chez les patients immunodéprimés, les femmes enceintes, et les enfants en bas âge, les complications suivantes peuvent survenir : pneumonie, encéphalite, kératite et infection bactérienne secondaire. Le taux de mortalité est estimé à 0-6 % pour la souche ouest Africaine et 8-10 % pour la souche du bassin du Congo (3), comparé à 30% pour la variole (Smallpox) (1). À ce stade, il n’y a pas encore eu de décès rapporté pour l’épidémie actuelle (1).
Diagnostic
La démarche diagnostique est d’abord clinique, typiquement devant des lésions cutanées associées ou non à des symptômes généraux, chez un patient avec facteur de risque épidémiologique (voyage récent en zone endémique, HSH).
L’institut de santé publique en Belgique (Sciensano) a défini des cas suspects/possibles et des cas probables ainsi que l’attitude diagnostique à suivre (8).
Un cas confirmé est un patient qui a un test PCR MPX positif ou un test PCR orthopoxvirus positif avec début des symptômes à partir du 1e mars 2022.
Un cas probable/suspect est un patient présentant une éruption inexpliquée ET un ou plus autre symptôme(s) d’infection survenu(s) à partir du 1e Mars 2022 (fièvre, maux de tête, mal de dos, fatigue, lympho-adénopathie (localisée ou généralisée)) ET un des critères suivants :
- lien épidémiologique avec un cas confirmé ou probable de variole du singe dans les 21 jours précédant l'apparition des symptômes ;
- antécédents de voyage dans un pays endémique (Afrique occidentale ou centrale) dans les 21 jours précédant l'apparition des symptômes ;
personne qui a eu des partenaires sexuels multiples ou anonymes dans les 21 jours précédant l'apparition des symptômes (quelle que soit son orientation sexuelle) ;
homme ayant des relations sexuelles avec d’autres hommes.
Un cas possible est un patient présentant une éruption maculo-papuleuse ou vésiculo-pustuleuse inexpliquée à distribution centrifuge, avec des lésions présentant une croûte, une lymphadénopathie et un ou plusieurs autres symptômes compatibles avec la variole du singe OU un ou plusieurs symptômes possibles du MPX chez un contact à risque élevé ou très élevé OU un ou plusieurs symptômes possibles du MPX chez un professionnel de la santé qui a été en contact avec un cas confirmé (contact avec des lésions cutanées ou contact prolongé en face à face), indépendamment de l'utilisation d'EPI (équipement de protection individuelle).
La confirmation se fait donc, comme mentionné plus haut, par la réalisation d’une PCR sur un frottis d’une lésion cutanée préférentiellement, ou, en cas d’absence de lésion cutanée, via une PCR sur frottis de gorge (ou sur expectorations). Il faut réaliser un seul frottis au niveau de la gorge (frottis Amies) et 2 frottis au niveau des lésions cutanées (3).
Un dosage de sérologies (ELISA IgM/IgG) est également possible mais relativement peu utile vu le délai de réponse et les nombreuses réactions croisées (4).
Une biologie complète devrait être réalisée chez tout patient à risque de développer une forme sévère (immunosuppression, grossesse, bas âge) ou en cas de présence de signes de sévérité de la maladie.
Le diagnostic différentiel comprend : certains Poxvirus (dont Molluscum contagiosum), l’Herpès virus (dont la Varicelle - VZV, l’Herpès génital - HSV), le virus de l’immunodéficience humaine (VIH), la gonorrhée (Neisseria gonorrhoeae), la Syphilis (Treponema pallidum), la lymphogranulomatose vénérienne (Chlamydia trachomatis L1/L2/L3), la gale (Sarcopte), et le chancre mou (Haemophilus ducreyi) (7).
Mesures préventives
Précautions d’hygiène et d’isolement
Conseils pour un cas suspect/confirmé en cas d’hospitalisation
À l’hôpital il est conseillé d’utiliser un équipement de protection individuelle dès la suspicion d’infection par le poxvirus, incluant des gants, une blouse, des lunettes et un masque FFP2 ou N95. Les lésions du patient doivent être couvertes et le port du masque est obligatoire pour le patient. Les procédures standards de désinfection de chambre sont suffisantes. Tous les déchets doivent être triplement emballés (9).
Conseils pour un cas suspect/confirmé en cas de retour au domicile
À domicile il est demandé de respecter un isolement strict sans contact physique (dans une chambre à part si possible et sans partage de linges de maison, vêtements, essuies, vaisselle...). Il faut également éviter un contact avec des animaux de compagnie (surtout les rongeurs). Le port du masque chirurgical est préconisé si un contact est nécessaire. Il est également recommandé de recouvrir les lésions. Enfin, il est conseillé de laver les vêtements, draps et essuies à 60° et de nettoyer l’environnement avec de l’eau de Javel. L’ensemble de ces mesures doivent être prises en compte durant 21 jours ou jusqu’à résolution des lésions cutanées (chute des croûtes) (8).
Conseils pour les cas contacts
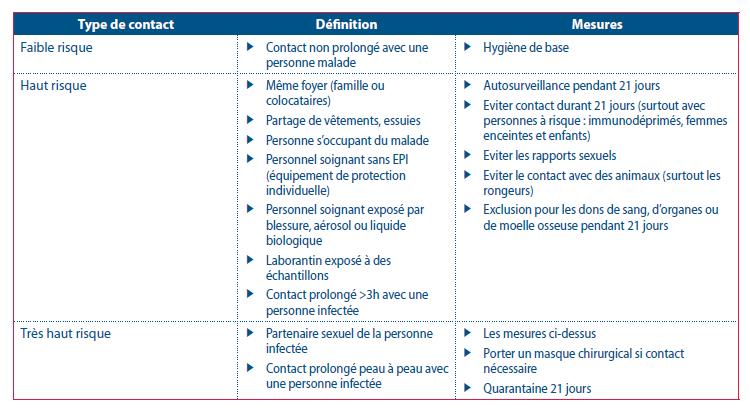
En Belgique l’Institut de santé publique Sciensano distingue les contacts à très haut risque des contacts à haut risque et faible risque et propose des mesures adapter à chaque niveau de risque. Le tableau 1 résume ces mesures (8).
Vaccination
La vaccination existante contre la variole (Smallpox) présente 85% d’efficacité croisée contre le Monkeypox (1). Il y a 40 ans on estimait que 80% de la population était immunisée contre la variole, actuellement on considère que cette protection se situe aux alentours de 30% (1). La présence d’une cicatrice au niveau de l'épaule est généralement la preuve que l’on a été vacciné contre la variole.
Actuellement, il y a deux vaccins efficaces sur le marché: ACAM2000® (2007) et Imvanex® (2019). Les deux vaccins sont des vaccins vivants atténués et pourraient être utilisés en vue d’une prophylaxie post-exposition des cas contacts et dans une plus large mesure pour la prévention pré-exposition (1,3).
Contrairement à l’ACAM2000®, l’Imvanex® est un vaccin MVA (modified vaccinia Ankara) hautement atténué qui a la particularité d'être "réplication déficient", ce qui implique que le virus ne peut plus être transmis de la personne vaccinée à ses contacts. Il présente par ailleurs un profil de sécurité excellent, même chez les immunodéprimés. Le vaccin peut être donné dans les 4 jours pour prévenir la maladie et jusqu’à 14 jours pour diminuer la gravité de celle-ci (1,3).
En Belgique, le conseil supérieur de la santé recommande depuis le 1er juin 2022 une vaccination par Imvanex® (2 doses à 28 jours d’intervalle) de préférence dans les 4 jours post-exposition (sous-cutané, dans le bras) (10).
Étant donné le peu de stock disponible à l’heure actuelle, cette vaccination est réservée aux contacts à très haut risque dans les 4 jours suivant l’exposition, pour prévenir l’infection. Pour les personnes à risque de maladie sévère, le vaccin peut être envisagé jusqu’à 14 jours après l’exposition pour réduire la sévérité des symptômes.
Le vaccin est également conseillé chez les patients à risque de maladie sévère qui ont présenté un contact à haut risque , de préférence dans les 4 jours suivant l’exposition jusqu’à maximum 14 jours.
Ces recommandations de vaccination sont fort susceptibles d'être modifiées dans un avenir proche, lorsqu’un nouveau stock de vaccins sera disponible, et pourraient être élargies à une prophylaxie post exposition (PEP) de toute personne ayant eu un contact à très haut risque ou à haut risque. Par ailleurs (ce qui semble moins probable), si le taux de cas venait à augmenter de manière exponentielle, la vaccination pourrait être élargie à des groupes à risque (HSH, travailleurs du sexe, femmes enceintes, enfants, soignants) qui n’ont pas été en contact avec un cas positif, voire à la population belge entière en commençant par ceux qui n’ont pas été vaccinés pour le Smallpox (10).
Traitement
Il existe deux antiviraux par voie orale (Tecovirimat et Brincidofovir) qui pourraient être envisagés dans le futur en cas de présentation sévère ou d’éruption floride chez les patients immunodéprimés, les enfants en bas âge et les femmes enceintes. Le Tecoviromat a déjà été approuvé par le FDA en 2018 pour l’usage contre plusieurs types de poxvirus (dont le Monkeypox) et prévient la formation de l’enveloppe virale par inhibition d’une proteine p37 (3). Le Brincidofovir est une prodrogue de Cidofovir, déjà approuvé pour le traitement des rétinites à CMV. Son usage contre le Monkeypox a été approuvé en 2021 (4). L’administration d’immunoglobulines (Vaccinia immune globulin) fait également l’objet d’études.
En pratique, ces médicaments ne sont pas encore disponibles pour l’instant en Belgique mais pourraient l’être dans le futur.
Conclusion
Le Monkeypox est surtout responsable d’une éruption cutanée vésiculaire associée ou non à des symptômes généraux. La transmission se fait via contact direct et dans une moindre mesure par gouttelettes. C’est un virus peu dangereux avec un taux de mortalité très faible dans la population générale. Les personnes à risque de complications sont les patients immunodéprimés, les enfants en bas âge et les femmes enceintes. Le traitement antiviral n’est à l’heure actuelle pas encore disponible en Belgique et les stocks de vaccins sont très restreints, limitant l’indication à un très petit groupe de patients. Il est recommandé de faire une quarantaine jusqu’à guérison complète des lésions pour éviter la transmission. La plupart des personnes touchées en Europe appartiennent à la communauté homosexuelle mais il n’y a pour l’instant aucune preuve d’une transmission par voie sexuelle. Plusieurs études (physiopathologie, transmission, traitement) sont en cours.
Dans le futur, nous serons probablement de plus en plus confrontés à des zoonoses au vu de l’augmentation des contacts entre homme et animal, secondaire à la déforestation, l’insécurité, l’instabilité géopolitique, les vagues migratoires, mais également le changement climatique.
Recommandations pratiques
- Dépister rapidement les patients suspects d’être atteints par le Monkeypox virus.
- Isolement strict des patients testés positifs et mesures préventives chez les patients contacts à haut risque et très haut risque.
- Vacciner le personnel soignant ayant présenté un contact à haut risque ou les personnes immunodéprimées.
- Rester à jour quant aux nouvelles recommandations à venir, notamment de vaccination et d’éventuels traitements antiviraux.
Affiliations
Service de Médecine Interne et des Maladies Infectieuses, Cliniques universitaires Saint-Luc UCLouvain, B-1200 Bruxelles
* Les auteurs ont contribué de façon égale
Correspondance
Pr. Jean Cyr Yombi
Cliniques universitaires Saint-Luc
Service de Médecine interne et des Maladies infectieuses
Avenue Hippocrate 10
B-1200 Bruxelles
Jean.Yombi@uclouvain.be
Conflits d’intérêt
Les auteurs n’ont aucun conflit d’intérêt.
Références
- Harris E. What to Know About Monkeypox. JAMA. 2022;327(23):2278–2279. doi:10.1001/jama.2022.9499
- Arita I., Gispen R., Kalter S. Outbreaks of monkeypox and serological surveys in nonhuman primates. Bull Org mond Sante. 1972, 46, 625-631.
- Potter C, Warmbrod L, Vahey R., Browett A. Fact Sheet. https://www.centerforhealthsecurity.org/our-work/pubs_archive/pubs-pdfs/...
- Adler H, Gould S, Hine P. Clinical features and management of human monkeypox: a retrospective observational study in the UK. Lancet. 2022. 2022; DOI:https://doi.org/10.1016/S1473-3099(22)00228-6
- Morse J, MD, MPH, FAAFP, Medical Director. Report to the Boards of Health. Mid-Michigan District Health Department, Wednesday, June 22, 2022.
- Mathieu E, Dattani S, Ritchie H, Roser M. "Monkeypox". 2022; Published online at OurWorldInData.org. Retrieved from: 'https://ourworldindata.org/monkeypox' [Online Resource]
- Basgoz N, Brown C, Smole S. Case 24-2022: A 31-Year-Old Man with Perianal and Penile Ulcers, Rectal Pain, and Rash. NEJM. June 2022. DOI: 10.1056/NEJMcpc2201244
- Sciensano. La variole du singe (Monkeypox) informations pour les personnels de santé. Version 2 juin 2022.
- Nörz D, Pfefferle S, Brehm T et al. Evidence of surface contamination in hospital rooms occupied by patients infected with monkeypox, Germany, June 2022. Euro Surveill. 2022;27(26):pii=2200477. https://doi.org/10.2807/1560-7917.
- Superior Health Council, Vaccination strategy against Monkeypox, SHC n° 9720, June 2022